Autori:┬ĀDr.ssa Irene Frezzato, Dr. Francesco Mangano, Dr. Alberto Frezzato
Negli ultimi anni abbiamo assistito ad una considerevole evoluzione in campo implantare. Micro e macro-geometria degli impianti, connessioni implant-abutment pi├╣ ricercate in termini di stabilit├Ā, di sigillo batterico, di forma atte a favorire una migliore costituzione dellŌĆÖampiezza biologica, maggiore consapevolezza dei tempi e del tipo di carico protesico, soluzioni protesiche pi├╣ attente agli aspetti biologici della connessione, procedure chirurgiche implantari a sempre minore invasivit├Ā, maggiore predicibilit├Ā delle tecniche ricostruttive delle selle edentule. Sono solo alcuni esempi dei progressi raggiunti. Tutto questo ci permette di trattare un numero via via crescente di pazienti che anni or sono avremmo difficilmente potuto trattare.
La buona predicibilit├Ā dei trattamenti implantari ha altres├¼ condizionato le scelte terapeutiche in altre branche, come la conservativa e la parodontologia ed ha anche portato alcuni clinici a utilizzare lŌĆÖimplantologia come prima, se non unica, scelta terapeutica. Sembra, talvolta, che ci dimentichiamo che gli impianti non sono denti, ma sostituti dei denti. E in questa entusiastica adesione allŌĆÖimplantologia rischiamo di dimenticare il possibile rischio di malattia perimplantare. La malattia perimplantare costituisce una realt├Ā con cui, prima o dopo, dobbiamo misurarci. Comprende due entit├Ā cliniche cui viene riconosciuta una genesi batterica (Lindhe e Meyle 2008): la mucosite peri-implantare e la peri-implantite (Zitzmann e Berglundh 2008).┬Ā Negli anni abbiamo imparato molto su questa malattia, ma non abbiamo ancora una soluzione certa: cercare di prevenire la malattia perimplantare ├© lŌĆÖunica opzione praticabile attualmente. La cura della perimplantite rappresenta una delle sfide future in campo implantare.
In questo articolo cerchiamo di illustrare questi concetti tramite la presentazione di alcuni casi clinici da noi trattati.
La mucosite peri-implantare consiste in una lesione infiammatoria localizzata alla mucosa peri-implantare senza evidenza clinica di perdita ossea. Pu├▓ evolvere in peri-implantite. Se trattata ├© reversibile.
Il caso clinico di seguito esposto, rappresenta un esempio di come non si debba fare implantoprotesi, ma ci ├© utile come esempio di mucosite peri-implantare, oltrech├® di contenzioso medico-legale. ├ł giunto alla nostra osservazione a distanza di 8 mesi dalla fine del trattamento consistito in una riabilitazione completa dellŌĆÖarcata inferiore mediante procedura implantare post-estrattiva immediata con carico immediato a 48 ore.
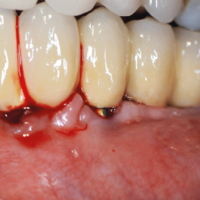
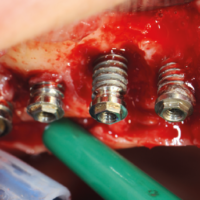
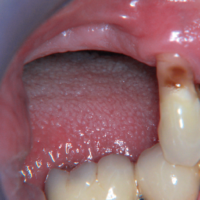
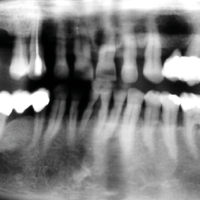
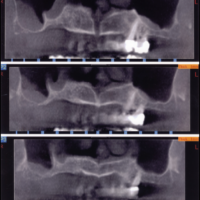
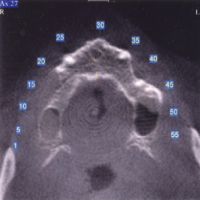
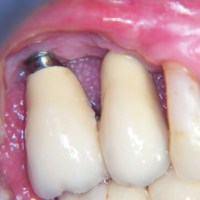
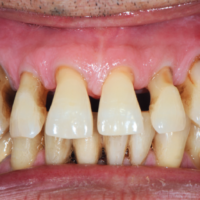
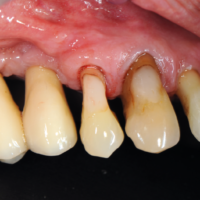
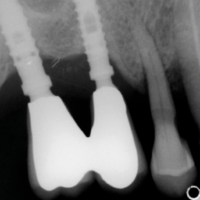
La paziente accusa fastidio generalizzato alle gengive con saltuario dolore in alcuni distretti, sanguinamento spontaneo e alla spazzolatura, difficolt├Ā nelle manovre igieniche, difficolt├Ā masticatoria, estetica insoddisfacente. Le immagini cliniche e radiografiche (Figg. 1-7) mostrano come il risultato finale sia dovuto a non corretta formulazione del piano di trattamento e a non corretta esecuzione delle procedure chirurgiche e protesiche. Il posizionamento errato degli impianti nei tre piani dello spazio comporta lŌĆÖesposizione delle spire, in particolare sul versante vestibolare, impedendo la formazione di una ampiezza biologica adeguata a preservare lŌĆÖosso peri-implantare. La mancanza o la scarsit├Ā di gengiva aderente costituisce ulteriore fattore di aggravamento del quadro. Noi sappiamo che per poter eseguire una implantologia in un unico tempo dobbiamo essere in presenza di una adeguata banda di mucosa aderente (Warrer et al 1995; Schrott et al 2009).
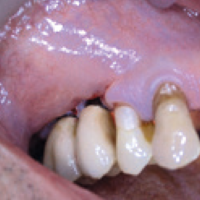
- Fig. 1 – Quadro clinico di mucosite perimplantare iatrogena: colletti implantari esposti, protesi incongrua, scarsit├Ā di mucosa aderente, sanguinamento spontaneo e indotto
- Fig. 2 – Quadro clinico di mucosite perimplantare: la protesi incongrua non permette le pratiche di una corretta igiene. Il sondaggio evidenzia la presenza di spire esposte sotto la mucosa, che appare sottile, scollata dalle superfici implantari e scarsamente cheratinizzata
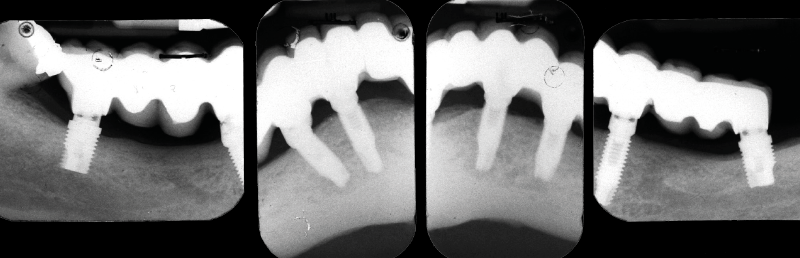
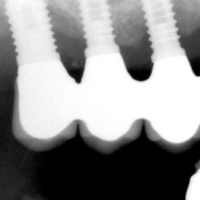
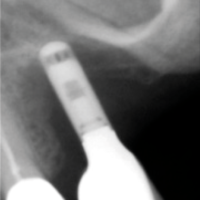
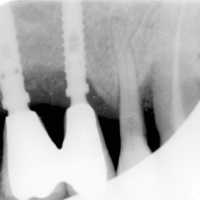
- Fig. 3 – Le radiografie endorali di fine trattamento evidenziano una incongruit├Ā della protesi, che appare sollevata nei settori posteriori.Tale condizione determina una impossibilit├Ā alla detersione a livello della connessione implant-abutment con conseguente accumulo di placca e compromissione dellŌĆÖampiezza biologica
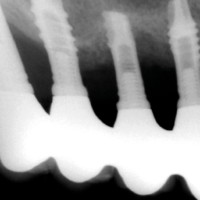
- Figg. 4-7 – Le immagini Cross della TC evidenziano un non corretto posizionamento implantare; gli impianti non completamente inseriti dentro lŌĆÖosso e troppo vestibolarizzati presentano spire esposte e questo contrasta la formazione di una stabile ampiezza biologica
La reversibilit├Ā della mucosite peri-implantare risulta legata ad una riduzione della carica batterica, attuabile tramite igiene professionale e domiciliare. Nel caso presentato mancano le condizioni anatomiche e biologiche per poter pensare ad una restitutio ad integrum. Si pu├▓ eventualmente pensare ad una implantoplastica delle superfici implantari extra-ossee, dopo temporanea rimozione della protesi e apertura di lembo, con associati innesti di connettivo circum-implantari. ├ł un trattamento di compromesso al fine di non dover rifare completamente il lavoro. In mancanza di trattamento tale quadro andr├Ā nel tempo peggiorando fino a sfociare in una peri-implantite.
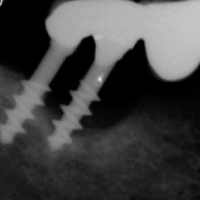
Con il termine di peri-implantite intendiamo un processo infiammatorio attorno agli impianti associato a significativo e progressivo riassorbimento osseo (EAO 2012). LŌĆÖeziologia primaria ├© dovuta ad infezione batterica (Mombelli 2002) (Figg. 8, 9). Il caso di seguito riportato ├© stato trattato con un approccio chirurgico di osteoplastica e implantoplastica (Fig. 10). Tale approccio pu├▓ essere utilizzato nelle zone non a valenza estetica e come trattamento di temporeggiamento. Ulteriori informazioni sulla metodica possono essere reperite nel libro: ŌĆ£LŌĆÖimpianto singolo: dalle evidenze scientifiche ai risultati cliniciŌĆØ; ISO Edizioni, ottobre 2014, pag.170-173.
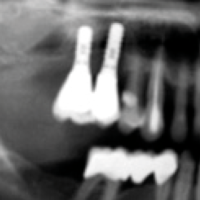
- Fig. 8 – Perimplantite: lŌĆÖapertura di un lembo permette di evidenziare la perdita crateriforme di tessuto osseo perimplantare. Il tessuto infiammatorio ├© gi├Ā stato rimosso
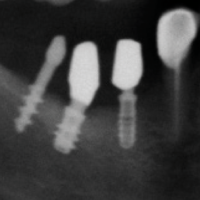
- Fig. 9 – Perimplantite: lŌĆÖimmagine radiografica preoperatoria evidenzia la perdita ossea crateriforme circum-implantare
- Fig. 10 – Perimplantite: lŌĆÖimmagine radiografica dopo intervento di osteoplastica ed implantoplastica evidenzia lŌĆÖassenza delle spire implantari nelle porzioni extra-ossee degli impianti
in dagli anni ŌĆś90 si ├© associato lŌĆÖinsuccesso implantare alla presenza rilevante di accumulo di placca batterica. Uno studio retrospettivo su 558 impianti (Br├źnemark System) in 159 pazienti ha rilevato che il 2% dellŌĆÖinsuccesso implantare dopo 2/3 anni era dovuto principalmente ad un rilevante accumulo di placca batterica (Van Steenberghe et al 1993). La perdita ossea non ├© reversibile (Albrektsson e Isidor 1994). Il fenomeno ├© stato studiato negli anni e oggi sembra esteso. Revisioni sistematiche della letteratura (Zitzmann e Berglundh 2008) hanno esaminato studi longitudinali e trasversali con almeno 50 pazienti trattati con impianti, per un periodo di almeno 5 anni di carico masticatorio.
Le mucositi peri-implantari si manifestano nellŌĆÖ80% dei soggetti e nel 50% degli impianti. Le peri-implantiti si manifestano nel 56% dei soggetti e nel 28% dei siti implantari. Una pi├╣ recente revisione sistematica della letteratura (Atieh et al 2013) riguardante un totale di 1497 pazienti per complessivi 2283 impianti, riporta una mucosite implantare nel 63,4% dei soggetti e nel 30,7% degli impianti. La peri-implantite viene diagnosticata nel 18,8% dei soggetti e nel 9,6% degli impianti. Un recente lavoro (Schmidlin et al┬Ā 2012) ha valutato la frequenza di peri-implantiti in Svizzera. La peri-implantite ha interessato il 5-6% degli impianti dopo 5 anni e il 7-9%┬Ā degli impianti dopo 10 anni. Non sono evidenziate e confrontate le percentuali di peri-implantite dei diversi sistemi implantari.
Come emerge dai lavori sopra riportati notiamo una diversit├Ā di dati circa lŌĆÖincidenza della malattia peri-implantare, dovuto sicuramente alla difficolt├Ā di raggruppare dati provenienti da studi diversi, ma probabilmente anche ad una valutazione solamente radiografica, interpretando ogni riassorbimento osseo come peri-implantite. Attualmente per peri-implantite intendiamo un quadro clinico-radiologico in cui siano associati diversi aspetti: sondaggio elevato, sanguinamento, presenza di essudato, riassorbimento osseo radiograficamente evidenziabile.
La sola presenza di aumento della profondit├Ā di sondaggio e sanguinamento al sondaggio non sono di per s├® indice di peri-implantite. Molti sono i fattori eziologici coinvolti nellŌĆÖinsorgenza della peri-implantite e diversi autori hanno cercato una correlazione con le caratteristiche di superfice (Albouy et al 2011; Renvert et al 2011). Se lŌĆÖinstaurarsi della malattia ├© simile tra impianti lisci e ruvidi, la differenza risiede nella progressione della malattia, sicuramente pi├╣ rapida nelle superfici ruvide (Berglundh et al 2007; Renvert et al 2011).
Di contro revisioni sistematiche sugli impianti corti (Renouard e Nisand 2006; Annibali et al 2012) hanno dimostrato come le superfici ruvide giochino un ruolo fondamentale nella sopravvivenza implantare e permettano di raggiungere per gli impianti corti┬Ā la stessa predicibilit├Ā degli impianti pi├╣ lunghi. UnŌĆÖaltra revisione sistematica della letteratura (Zetterqvist et al 2013) riporta la presenza di peri-implantite in 23 studi con differenti sistemi implantari. I risultati a 5 anni non hanno mostrato aumento del rischio di insorgenza di peri-implantite per impianti completamente ruvidi rispetto agli impianti ibridi. Si pu├▓ riflettere su come il periodo osservazionale di 5 anni sia insufficiente a trarre delle conclusioni in quanto la peri-implantite comincia ad avere una incidenza significativa dopo i 5-7 anni dal carico masticatorio.
LŌĆÖesperienza clinica degli utilizzatori di impianti Morse Taper, e nel particolare di impianti Exacone, fa rilevare una pi├╣ bassa incidenza di malattia peri-implantare rispetto a quanto riportato in letteratura. Recenti studi con follow-up a 10 anni su impianti Exacone (Mangano et al 2014) mostrano come complicanze biologiche di questo tipo sono, anche dopo 10 anni, eventi estremamente rari che colpiscono meno del 2% degli impianti inseriti. Infatti di 939 restauri implanto-protesici monitorati a 10 anni soltanto lŌĆÖ1,4% ha presentato complicanze biologiche (11 restauri su 15 impianti).
Si tratta di 2 impianti con mucosite peri-implantare, 10 impianti con infezioni peri-implantari dolorose (che sono state tutte trattate con successo, senza che gli impianti siano andati perduti) e 3 impianti con un riassorbimento osseo peri-implantare maggiore di 1,5 mm dopo il primo anno di carico senza alcun segno clinico di infezione peri-implantare. Questi dati potrebbero indicare che lŌĆÖimpiego di un sistema implantare con connessione a cono Morse, caratterizzato da un comprovato sigillo batterico (Zipprich 2011; Giorgini et al 2013), pu├▓ contribuire alla riduzione dellŌĆÖincidenza di malattia peri-implantare nel medio-lungo termine.
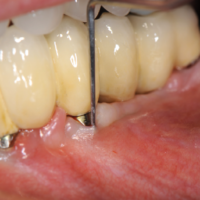
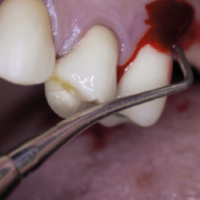
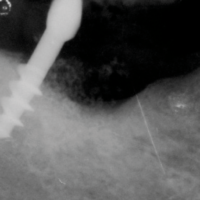
Il quadro clinico della peri-implantite si manifesta con severa flogosi mucosa (accumulo di placca, edema, arrossamento, sanguinamento spontaneo e indotto, fastidio e dolore gengivale, essudato purulento), con accentuata profondit├Ā di sondaggio, cui corrisponde una perdita ossea radiograficamente dimostrabile e, in fase tardiva, con mobilit├Ā dellŌĆÖimpianto (Figg. 11, 12). La lesione ├© irreversibile. LŌĆÖimpianto ├© perso.
- Fig. 11 – Perimplantite: sanguinamento spontaneo ed indotto, sondaggio patologico con fuoriuscita di pus
- Fig. 12 – Perimplantite: lŌĆÖimmagine radiografica mostra la perdita completa di osso perimplantare
La perdita dellŌĆÖimpianto comporta la programmazione di un nuovo piano di trattamento, non sempre di facile soluzione.
Il caso di seguito presentato riguarda un paziente di 54 anni giunto alla nostra osservazione a fine 2003 con un quadro di fallimento implantoprotesico su due impianti in sede 15 e 16 inseriti nel 2001 presso studio della zona. ├ł un paziente a rischio perch├® parodontale, fumatore, diabetico, igienicamente non motivato. La protesi implantare ├© mobile, la gengiva dolente e secernente pus. LŌĆÖunico piano di trattamento possibile ├© la rimozione degli impianti e la decontaminazione del sito tramite curettage in copertura antibiotica (Figg. 13-15).
- Fig. 13 – Case report di perimplantite al primo quadrante: documentazione radiografica di perdita ossea attorno agli impianti
- Fig. 14 – Segni di flogosi mucosa perimplantare. Mobilit├Ā protesica. Dolore. Sono espressioni cliniche di perimplantite
- Fig. 15 – La protesi implanto-supportata viene rimossa. La superficie implantare ├© contaminata, lŌĆÖosso ├© andato perduto e sostituito da tessuto di granulazione
A gennaio 2004 i tessuti sono guariti ed il quadro clinico e radiografico mostra una atrofia severa orizzontale e verticale al primo quadrante in zona distale al 14 (Figg.16, 17).
- Fig. 16 – Il sito post-estrattivo guarito, a distanza di alcuni mesi dalla rimozione implantare: atrofia orizzontale e verticale
- Fig. 17 – La radiografia panoramica del sito estrattivo mostra una ridotta disponibilit├Ā ossea verticale
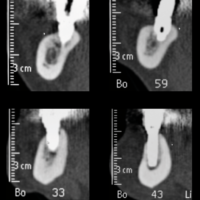
La diagnosi viene confermata dalle immagini TCCB. In particolare le varie sezioni panoramiche mostrano una ridotta altezza ossea da perdita di osso crestale e da espansione sinusale, con presenza di un ispessimento della mucosa sinusale da sinusite cronica iperplastica.
LŌĆÖimmagine assiale mostra una riduzione dello spessore crestale da perdita ossea vestibolare (Figg. 18,19).
- Fig. 18 – Le immagini panoramiche TC mostrano una riduzione verticale di osso al primo quadrante, sia per espansione sinusale, sia per riduzione verticale della cresta ossea
- Fig. 19 – LŌĆÖimmagine assiale TC mostra una perdita di spessore osseo al primo quadrante sul versante vestibolare
Il trattamento da noi attuato consiste in una riabilitazione implanto-protesica di 15 e 16 mediante ripristino volumetrico del sito implantare contestuale allŌĆÖinserimento dei due impianti.
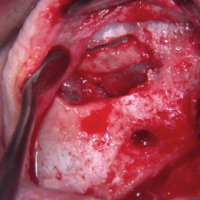
LŌĆÖapertura di un lembo a tutto spessore permette di eseguire un sinus lift lateral approach: la finestrella ossea viene ribattuta al di sotto della membrana sinusale scollata e sollevata, lo spazio sub-sinusale viene riempito di biomateriale e coperto con spugna di fibrina (Fig. 20).
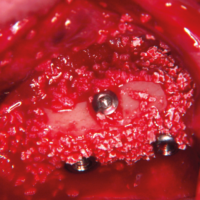
Due impianti Exacone vengono inseriti in posizione 15 (diametro 3,3 mm) e 16 (diametro 4,1 mm) parzialmente extra-crestali, servendo di sostegno al biomateriale nella procedura GBR (Fig. 21).
- Fig. 20 – Sinus Lift Lateral Approach: la finestrella ossea vestibolare viene sollevata verso lŌĆÖalto insieme alla membrana sinusale scollata
- Fig. 21 – Lo spazio sub-sinusale ├© stato riempito con biomateriale in granuli e lŌĆÖaccesso laterale tamponato con spugne di fibrina. Due impianti sono stati inseriti in posizione 15 e 16 parzialmente extra-crestali, come sostegno al successivo biomateriale, nellŌĆÖambito della procedura rigenerativa crestale
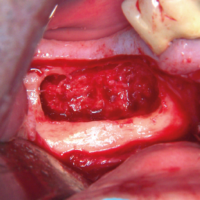
Dal corpo mandibolare dx viene eseguito un prelievo di corticale vestibolare e di bone chips, utilizzati per il ripristino volumetrico verticale e trasversale del sito implantare (Figg. 22-24).
- Fig. 22 – Viene eseguito un prelievo di corticale ossea sul versante vestibolare del quarto quadrante, dopo apertura di lembo a tutto spessore
- Fig. 23 – Dal sito donatore viene prelevato anche osso midollare, che andr├Ā zeppato attorno allŌĆÖinnesto a blocco
- Fig. 24 – Stecca di corticale ossea da prelievo intraorale conservata in fisiologica prima della fissazione
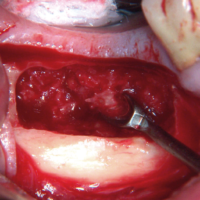
La stecca ossea viene fissata con una vite alla parete vestibolare del sito. Biomateriale in granuli viene aggiunto a copertura dellŌĆÖinnesto osseo (Figg. 25-27).
- Fig. 25 – LŌĆÖinnesto di corticale ossea viene fissato con vite da osteosintesi alla corticale vestibolare crestale. Bone chips vengono posizionate vestibolarmente negli spazi vuoti
- Fig. 26 – La copertura con biomateriale sintetico granulare completa la ricostruzione volumetrica del sito
- Fig. 27 – Immagine radiografica post-operatoria del sito
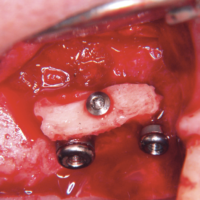
A quattro mesi si connettono i tappi di guarigione, dopo esposizione spontanea dei tappi di chiusura. I processi di guarigione hanno comportato un certo ritiro tissutale (Figg. 28, 29).
- Fig. 28 – Immagine fotografica del sito a 4 mesi dallŌĆÖintervento. Si inseriscono i tappi di guarigione. Si nota un certo grado di retrazione tissutale
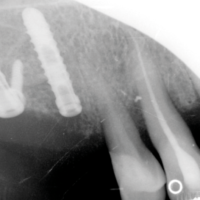
- Fig. 29 – Il controllo radiografico endorale mostra un buon esito della procedura di rialzo sinusale. Disomogenea appare la trama dellŌĆÖinnesto corticale
- Fig. 30 – Consegna della protesi 15 e 16 consistente in due corone metal-ceramica saldate tra loro
- Fig. 31 – La radiografia endorale alla consegna mostra il corretto fitting corone-monconi. La trama della cresta ossea appare disomogenea, espressione di iniziale riassorbimento del bioinnesto
Il paziente ├© stato pi├╣ volte informato della sua situazione di rischio. Nel tempo ha smesso di fumare, ha migliorato le abitudini alimentari, esegue una attenta igiene orale, e si presenta regolarmente ai controlli periodici.
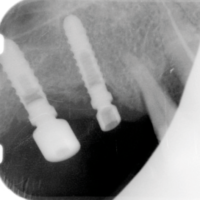
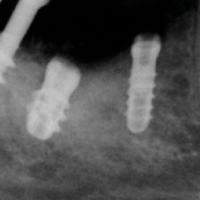
A distanza di 13 anni il quadro clinico-radiografico risulta soddisfacente. La radiografia mostra un riassorbimento osseo peri-implantare in assenza di segni clinici di flogosi. Probabilmente il quadro si trasformer├Ā in peri-implantite. Il paziente continuer├Ā ad essere attentamente monitorato e sottoposto a terapia di supporto implantare (Figg. 32-34).
- Fig. 32 – Controllo clinico a 13 anni. Diffusa retrazione tissutale parodontale, soddisfacente igiene orale
- Fig. 33 – Controllo del primo quadrante a 13 anni. Stabilit├Ā dei tessuti molli perimplantari e della protesi implantare
- Fig. 34 – Il controllo radiografico degli impianti mostra un riassorbimento osseo crestale orizzontale in corrispondenza del bioinnesto e il mantenimento dellŌĆÖintegrazione ossea a livello del corpo e dellŌĆÖapice implantare. Contrazione modesta dellŌĆÖosso apico-implantare, sede del rialzo sinusale
Riassumendo, abbiamo considerato due opzioni di trattamento della malattia peri-implantare: la chirurgia ossea resettiva con implantoplastica e lŌĆÖestrazione dellŌĆÖimpianto con successiva rigenerativa ossea e implantoprotesi. I nostri goals prevedono una terza opzione: la ricostruzione dellŌĆÖosso perduto e una nuova osteointegrazione dellŌĆÖimpianto. Le radiografie seguenti ne sono un esempio (Figg. 35, 36).
- Fig. 35 – Perimplantite di impianto 46 con estensione alla prima spira dellŌĆÖimpianto 47
- Fig. 36 – Rimozione dellŌĆÖimpianto 46, curettage, implantoplastica con rimozione della prima spira del 47, bioinnesto
La paziente di 50 anni presenta una peri-implantite dellŌĆÖelemento 46 con estensione allŌĆÖimpianto in posizione 47. Il trattamento consiste nella rimozione dellŌĆÖimpianto 46, nellŌĆÖimplantoplastica delle spire esposte del 47, nella rigenerativa ossea mediante innesto di biomateriale.
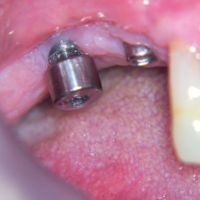
A guarigione avvenuta provvediamo ad inserire due nuovi impianti nella sella edentula, in posizione 45 e 46, che vengono protesizzati con corone singole analogamente allŌĆÖimpianto distale 47 pre-esistente (Figg. 37, 38).
- Fig. 37 – Inserimento di impianto Exacone Short 6,5 in sede 46 rigenerata e di impianto Exacone 3,3×10 nella sede edentula 45
- Fig. 38 – Protesizzazione dei 3 impianti con corone singole. Appare stabile il livello osseo nella zona del 47 sottoposta a bioinnesto dopo implantoplastica
In riferimento al 47, se risulta possibile ripristinare lŌĆÖosso peri-implantare perduto, non sufficientemente comprovata e predicibile risulta unŌĆÖeventuale re-osteointegrazione della superficie implantare prima esposta e trattata con implantoplastica.
La paziente andr├Ā sicuramente monitorata nel tempo. La compliance ├© buona. La malattia peri-implantare rappresenta un insuccesso dei nostri trattamenti implantoprotesici.
Sappiamo che il risultato immediato e nel tempo ├© legato a fattori chirurgici, protesici, biologici tra loro necessariamente interconnessi. La compliance del paziente risulta fondamentale. La nostra tranquillit├Ā come professionisti ├© di eseguire le varie procedure con estrema accuratezza in base allo stato dellŌĆÖarte. Esiste peraltro un quid di imprevedibilit├Ā indipendente dalla qualit├Ā del lavoro. Per questo confidiamo in Santa Apollonia, protettrice degli odontoiatri. Buon lavoro a tutti noi!
Bibliografia
– Albouy JP, Abrahamsson I, Persson LG, Berglundh T. Implant surface characteristics influence the outcome of treatment of peri-implantitis: an experimental study in dogs. J Clin Periodontol 2011;38(1):58-64
– Albreksson T, Isidor F. Consensus report: implant therapy. In: Lang NP, Karring T (eds). Proceedings of the 1st European Workshop on Periodontology. Berlin 1994: Quintessence: 365-9
– Annibali S, Cristalli MP, DellŌĆÖAquila D, Bignozzi I, La Monaca G, Pilloni A. Short dental implants: a systematic review. J Dent Res 2012;91(1):25-32
– Atieh MA, Alsabeeha NH, Faggion CM Jr, Duncan WJ. The frequency of peri-implant diseases: a systematic review and meta-analysis. J Periodontol 2013; 84(11):1586-1598
– Berglundh T, Gotfredsen K, Zitzmann NU, Lang NP, Lindhe J. Spontaneous progression of ligature induced peri-implantitis at implants with different surface roughness: an experimental study in dogs. Clin Oral Implants Res 2007;18(5):655-661
– Berglundh T, Lindhe J. Dimension of the periimplant mucosa. Biological width revisited. J Clin Periodontol 1996;23(10):971-973
– Giorgini G, Santangelo R, Bedini R, Pecci R, Manicone PF, Raffaelli L, Sanguinetti M, DŌĆÖAddona A. Dimensional and microbiological in vitro analysis of a dental implant locking taper connection. J Biol Regul Homeost Agents 2013;27(4):1077-88
– Khang W, Feldman S, Hawley CE, Gunsolley J.A multi-center study comparing dual acid-etched and machined-surfaced implants in various bone qualities. J Periodontol 2001;72:1384-1390 ┬Ā ┬Ā
– Klinge B, Meyle J, Working Group 2. Per-implant tissue destruction. The third EAO Consensus Conference 2012. Clin Oral Implants Res┬Ā 2012;23 Suppl 6:108-110
– Lang NP, Berglundh T; Working Group 4 of Seventh European Workshop on Periodontology. Periimplant diseases: where are we now? Consensus of the Seventh European Workshop on Periodontology. J Clin Periodontol 2011;38 Suppl 11:178-181
– Lindhe J, Berglundh T, Ericsson I, Liljenberg B, Marinello CP. Experimental breakdown┬Ā of periimplant and periodontal tissues. A study in the beagle dog. Clin Oral Implants Res. 1992;3:9-16
– Lindhe J, Meyle J; Group D of European Workshop on Periodontology. Peri-implant diseases: Consensus Report of the Sixth European Workshop on Periodontology. J Clin Periodontol 2008;35(8 Suppl):282-5
– Mangano F, Macchi A, Caprioglio A, Sammons R L, Piattelli A, Mangano C. Survival and complication rates of fixed restorations supported by locking-taper implants: a prospective study with 1 to 10 years of follow-up. J Prosthodont 2014;23(6):434-444
– Mangano F, Shibli JA, Sammons RL, Veronesi G, Piattelli A, Mangano C. Clinical Outcome of Narrow-diameter (3.3-mm) locking-taper implants: a prospective study with 1 to 10 years of follow-up. Int J Oral Maxillofac Implants 2014;29(2):448-455
– Mombelli A. Microbiology and antimicrobial therapy of peri-implantitis. Periodontol 2000┬Ā 2002;28:177-189
– Quirynen M, Abarca M, Van Assche N, Nevins M, Van Steenberghe D. Impact of supportive periodontal therapy and implant surface roughness on implant outcome in patients with a history of periodontitis. J Clin Periodontol 2007;34:805-815
– Renouard F, Nisand D. Impact of implant length and diameter on survival rates. Clin Oral Implants Res 2006;17(Supp 2):35-51
– Renvert S, Polyzois I, Claffey N. How do implant surface characteristics influence peri-implant disease? J Clin Periodontol 2011;38 Suppl 11:214-222
– Schmidlin PR, Sahrmann P, Ramel C, Imfeld T, M├╝ller J, Roos M, Jung RE. Peri-implantitis prevalence and treatment in implant-oriented private practices; a cross- sectional postal and internet survey. Schweiz Monatsschr Zahnmed 2012;122:1136-1144
– Schrott AR, Jimenez M, Hwang JW, Fiorellini J, Weber HP. Five-year evaluation of the influence of keratinized mucosa on peri-implant soft-tissue health and stability around implants supporting full-arch mandibular fixed prostheses. Clin Oral Implants Res 2009;20(10) 1170-1177
– Trombelli L, Farina R, Franceschetti G, Guarnelli ME, Scabbia A. Mantenimento della salute dei tessuti peri-implantari. In: Il Successo in implantologia: diagnosi, piano di trattamento e protocolli operativi (SIO), Edra Ed. 2013:567-597
– Van Steenberghe D, Klinge B, Lind├®n U, Quirynen M, Herrmann I, Garpland C. Periodontal indices around natural and titanium abutments: a longitudinal multicenter study. J Periodontol 1993;64(6):538-41
– Warrer K, Buser D, Lang NP, Karring T. Plaque-induced peri-implantitis in the presence or absence of keratinized mucosa. An experimental study in monkeys. Clin Oral Implants Res 1995;6(3):131-138
– Zipprich H. Rilevamento, cause e conseguenze dei micromovimenti a livello dellŌĆÖinterfaccia impianto-abutment. Quintessenza Internazionale, Speciale implantologia 2011;3bis:61-63
– Zetterqvist┬Ā L, Feldman S, Rotter B et al. Studio prospettico multicentrico┬Ā randomizzato controllato, della durata di cinque anni su impianti ibridi e acidificati per lŌĆÖincidenza di perimplantite. Journal of Implant and Reconstructive Dentistry 2013;1:24-25
– Zitzmann NU, Berglundh T. Definition and prevalence of peri-implant diseases. J Clin Periodontol 2008;35(Suppl 8):286-91